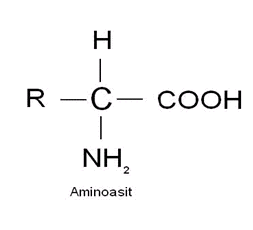
Proteinler hücrenin yapısında yer alan, C,H,O,N(Azot) ve S(kükürt) içeren,zincir şeklindeki aminoasitlerin birleşmesiyle (Polimerize olması) oluşan önemli organik bileşiklerdir.Proteinlerin temel yapısal birimi aminoasitlerdir.
 Proteinler hücrede yüzlerce aminoasitin polimerize olmasıyla meydana gelen makromoleküllerdendir..İlk keşfedilen aminoasit Asparagus sp.(Kuşkonması) bitkisinden elde edilen ” Asparajin” dir.1938 yılında W.C. Rose tarafından ”Threonin” ise en son keşfedilen aminoasittir.Doğada 20 çeşit aminoasit vardır.
Proteinler hücrede yüzlerce aminoasitin polimerize olmasıyla meydana gelen makromoleküllerdendir..İlk keşfedilen aminoasit Asparagus sp.(Kuşkonması) bitkisinden elde edilen ” Asparajin” dir.1938 yılında W.C. Rose tarafından ”Threonin” ise en son keşfedilen aminoasittir.Doğada 20 çeşit aminoasit vardır.Proteinlerin kimyasal yapısını incelediğimizde merkezde bir karbon(C) atomu ve bu atoma bağlı bir karboksil(-COOH) grubu ve amino(-NH2) grubu vardır.Bu iki yapı amimoasitlerin ortak temel yapısını teşkil eder.Amimoasitler arasındaki farklılığı ise (C)karbon atomuna bağlı (-R) grubu ve yan zincir sağlar.Aminoasitler ”R” grubunun kimyasal özelliklerine göre suda eriyenler ve suda erimeyenler olmak üzere iki gruba ayrılır.Amino grubu ve yan zincir grub,aminoasitlerin farklı elektrik yüklerine ve suda farklı çözünürlük oranlarına sahip olmalarını sağlar.Aminoasitler kısaltılmış olarak üç haf yada tek harf ile sembolize edilirler.Alanin –>Ala–>A gibi..
Karboksil grubu(-COOH) asidik,amino grubu(-NH2) bazik özellik gösterir ve bu sebeble hücrede meydana gelebilecek Ph değişimlerinde tampon görevi üstlenirler.
Suda Eriyenler Suda Eriyemenler
Serine(ser) Glysine (Gly)
Threonine (Thr) Alanine (Ala)
Cysteine (Cys) Valine (Val)
Tyrosine (Tyr) Leucine (Leu)
Aspargine (Asn) İsoleucine (Ile)
Glutamine (Gln) Methionine (Met)
Aspartic Asit (Asp) Phenylalanine (Phe)
Glutamic Asit (Glu) Tryptophan (trp)
Lysine (Lys) Proline (Pro)
Arginine (Arg)
Histidine (His)
Gliseraldehit referans alındığında aminoasitlerde D ve L formu adı verilen iki form vardır.Amino (NH2) grubu merkezi karbon(C) atomunun sağında ise D-Aminoasiti,amino(NH2) grubu merkezi karbon atomunun solunda ise L-Aminoasiti adını alır.
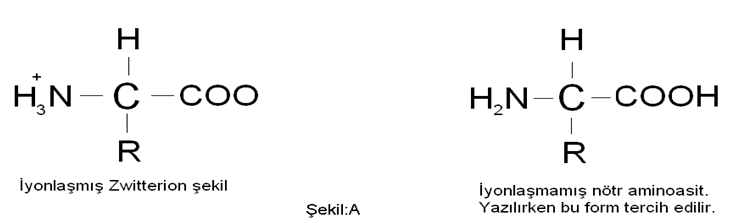
Aminoasitler nötr bir çözeltide yada ortamda Dipolar İyon(Zwitterion) yapısında bulunurlar.Buna karşın aminoasitler yazılırken yazılış bakımından kolay olduğu için iyonsuz(yüksüz) şekilde yazılırlar.Şekil:A
Aminoasitlerin sınıflandırılmasında kullanılan bir başka yöntem ise ”Kağıt Elektrofarez” yöntemidir.PH=5.5 ölçüsüne ayarlanmış bir çözelti ortamında kağıt eletrofarez testine tabii tutlan aminoasitler 3 gruba ayrılır.
1)5,5 Ph ortamında yüksüz olan ”Nötr Aminoasitler”
2)5.5 Ph ortamında pozitif elektrik yüklü olan ”Bazik Aminoasitler”
3)5.5 Ph ortamında birden fazla karboksil grubu bulunduran elektrik yükleri negatif olan ”Asidik Aminoasitler” adı verilir.
Bu gruplandırmaya uymayan bazı aminoasitlerde vardır.Alanin aminoasidi suda hem bazik ,hem asidik davranan amfoterik özelliğe sahiptir.Aşağıda listelendiği gibi kağıt elektrofarezi dışında çeşitli aminoasit analiz yöntemleri vardır.
1)Countercument Dağılımı
2)Kağıt Elektrofarezi
3)Gaz Kromatografisi
4)Çift yönlü Kağıt Kromatografisi
5)Icn-Exchange (İyon Değişimi) Kromatografisi
Hücrede aminoasitler şeker,nitrit(NH2),nitrat(NH3) kullanılarak sentezlenirler.Bu sentez yoluyla bitkiler 20 çeşit aminoasitide sentezleyebilirler,hayvanlar ve insanlar ise aminoasitlerin tümünü sentezleyemez.
İnsanlar Leucine,İsoleucine,Lysine,Threonine,phenylananine,Methioninei ve Valine dışında kalan aminositleri sentezlerken saydıklarımız dışında kalanları sentezleyemez.İnsanların üretemedikleri bu aminoasitlere temel-ana aminoasitler denir ve ihtiyaçlarını bitkilerden beslenme yolu ile karşılarlar.
Aminoasitler amino ve karboksil grupları arasında oluşan bir peptid bağı ile birbirine bağlanarak ”PEPTİD” adı verilen ürünü oluştururlar.Bu reaksiyon sonucunda 1 mol su(H2O) açığa çıkar(Dehidrasyon sentezi) ve iki aminoasitten oluşan bu ürünede ”Dipeptid” adı verilir.
Dipeptid sentezi-Dehidrasyon sentezi
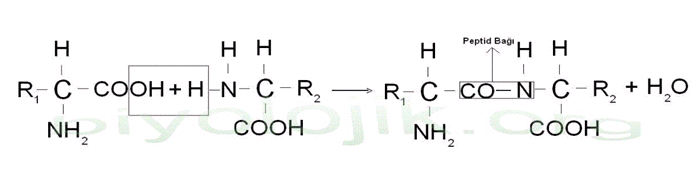
İkiden fazla birkaç aminoasitin oluşturduğu peptid zincirine ”OLİGOPEPTİD”,çok uzun zincirlerde ”POLİPEPTİD” denir.Saydığımız peptid yani aminoasit zincirlerinin uçlarında daima serbest karboksil(COOH) ve amino(NH2) grupları mevcuttur.
Üç aminoasit birbirine bağlanırsa ,örneğin glisin,tirozin ve alanin AGT,ATG,GAT,GTA,TAG,TGA 6 farklı dizilişyani 6 farklı protein molekülü oluşturabilir. 10 aminoasitten oluşan dekapeptidin 3.628.800,20 aminoasitin farklı dizilerde 2.4*1018 tane farklı amainoasit dizileri(sukuens) oluşacaktır.
Hücre içerisinde proteinler 1907 yılında uluslararası bir komite tarafından ikiye ayrılmıştır.
1)Basit Proteinler:
Hidrolize edildiklerinde sadece açığa çıkan yapıtaşı molekülü sadece aminoasit ise bunlara ”Basit Proteinler” adı verilir.Keratin,elastin,globülin,albuminve bazı enzimler örnek verilebilir.
2)Konjuge(Bileşik) Proteinler:
Hidrolize edildiklerinde açığa çıkan molekülleri arasında aminoasitlerde farklı moleküller varsa bu proteinlere ”Konjuge” proteinler” adı verilir.Protein ve yağ asitlerinden oluşan ”Lipoproteinler”,protein ve polisakkaritten oluşan ”Glikoprotein”,protein ve nükleik asitten oluşan ”Nükleoprotein” örrnek verilebilir
Makalemizin başlangıcında değindiğimiz gibi proteinlerin yapıtaşları aminoasitlerdir ve bu aminoasitlerin birleşerek oluşturdukları polipeptid zincirleri proteinleri oluşturur.Aminoasitlerin polipeptid zincirlerindeki sayıları,dizilişleri yani düzenlerine göre proteinlerde farklılıklar meyda getirir.Aminoasitlerdeki bu yerleşim farklılıklarına göre 4 farklı protein yapısı mevcuttur.Bunlar;
1)Primer yapı 2)Seconder yapı 3)Tersiyer yapı 4)Kuaterner yapı
1)Primer Yapı:
Proteinleri oluşturan polipeptid zincirindeki aminoasitlerin sırasına ”SUKUENS” adı verilir.Belirli bir düzen içerisinde aminoasitlerin polipeptid zincirindeki diziliş sukuensine proteinlerin ”Primer yapısı” diğer bir deyişle ”Birincil Yapısı” denir.Canlılarda bulunan çok sayıda ve farklı yapıda protein moleküllerinin bulunmasının sebebi aminoasit sukuensinin farklı olmasıdır.
2)Seconder Yapı
Seconder yapı(ikincil yapı) proteinlerin aktif ve fonksiyonel olan şeklidir.Protein sentezi sırasında polipeptid zincirindeki amainoasitlerin karboksil ve grubundaki oksijen atomu ve amino grubundaki hidrojen atomları arasonda hidrojen bağları oluşur.Hidrojen bağları sayesinde zincir 3 boyutlu bir düzen kazanmasını sağlar.(Konfigürasyon)Konfigürasyon işlemi sonucunda proteinleri iki farklı kıvrımlı yapıya sahip olur.Bunlar;
1)Beta Pileleri:Polipeptid zincirleri Spiral şekide kıvrılır. 2)Alfa Helix Yapısı:Polipeptid zincirleri Pileli şekilde katlanırlar.Örnek olarak saç,tırnak.
Seconder yapıya sahip proteinlere ”Fibrilli Proteinler” denir.İpek,deri ve bağ doku proteinleri,yün ve saç fibrilli protein yapısındadır.Fibroin,Keratinler ve Kollagen fibrilli proteinlerdir.İpek böceğinin kozası(kokonu) için gerekli olan sert ve esnekliği ”Fibroin” proteininden yapılan bu fibril sağlar.
Keratinde bir fibrilli proteindir.,insanlarda ve hayvanlarda epiderma hücreleri tarafından üretilir.Saç,tırnak,tüy,tüy sapı,boynuz ve toynaklar bir fibrilli protein olan keratin yapısındadır.Keratin Alfa helix yapısındadır.Keratin tipleri Alfa-Keratin ve Beta-Keratin olmak üzere ikiye ayrılır.
Alfa keratin sistein bakımından zengin,hayvan yünü ve insan saçının ana proteinidir.Sistein oranı azaldıkça keratin fibrilin esnekliğide artar.
Beta Keratin ise sistein iç bulunmaz ve reptil ve kuşlardaki pullar,kuş gagalarında,tüylerde,tırnaklarda bulunan yapısal bir proteindir.
3)Tersiyer Yapı:
Tersiyer yapı (üçüncül yapı) polipeptid zincirlerinde bulunan ”R” gruplarının yuvarlak topak şeklinde kıvrılması sonucu oluşan protein yapısıdır.
Globüler Proteinler hücrenin kimyasal sürecinin hemen hemen tümünde metabolizmasında rol oynayan tersiyer yapıya sahip yapısal bir proteindir.Örnek:Miyoglobin ve ribonükleaz.
4)Kuarterner Yapı:
En az iki yada daha fazla polipeptid zincirlerinden oluşan protein yapılarına ”kuaterner yapı ‘ denir.Örnek:İnsülin ve Glukagon.
Proteinlerin seconder,tersiyer ve kuarterner yapıları ve üç boyutlu şekillerinden, aminoasitler arasındaki hidrojen bağları,kovalent bağlar,polar ve apolar çekim kuvvetleri,Van Der Walls bağları,hidrofobik bağlar ve disülfit köprüleri sorumludur.Proteinler extrem ısı koşulları,ultraviole ışınları,Ph sınırları,ağır metaller,organik çözücüler ve deterjanlar proteinlerin üç boyutlu yapılarını(seconder,tersiyer,kuarterner) oluşturan bu bağların bozar ve proteinlerde Denatürasyona(bozulma) sebeb olur.
Proteinler canlıların hücre, doku ve organlarının yapısına katılan çok önemli organik maddelerdir.Öyleki metabolizmada düzenleyici uyarıcı görevler üstlenen enzimler ve hormonlar başlı başına birer proteindir.Örneğin;enzimlerden sükraz,düzenleyici proteinlerden insülin,depo proteinlerden yumurta akı,kandaki antikorlar canlılarda direkt biyolojik fonksiyonlara sahip protein çeşitleridir.Örnekleri çoğaltmakta mümkündür.Bu sebeplerden dolayı proteinler canlıların yaşamlarını sürdürebilmesi için beslenme menülerinde mutlaka bulunması gereken besinlerdir.Canlılarda proteinler enerji üretiminde hammadde olarak kullanılmaz.Birincil enerji hammaddesi karbonhidratlar,ikinci sırada yağlar,uzun süren açlık durumlarda proteinler kulanılır.Canlı metabolizmalarında protein sentezi,yıkım hızından düşük ise canlı için ölüm tehlikesi ortaya çıkar.